
本文由華中科技大學(xué)馬聰課題組與中國科學(xué)院廣州生物醫(yī)藥與健康研究院何俊團隊合作完成,揭示膜融合調(diào)控因子 Munc13-4 在腫瘤外泌體 PD-L1 分選與分泌中的關(guān)鍵作用。該研究不僅解析了免疫逃逸的新機制,也提出了靶向 Munc13-4–PD-L1 相互作用以提升免疫治療響應(yīng)的新策略。
背景
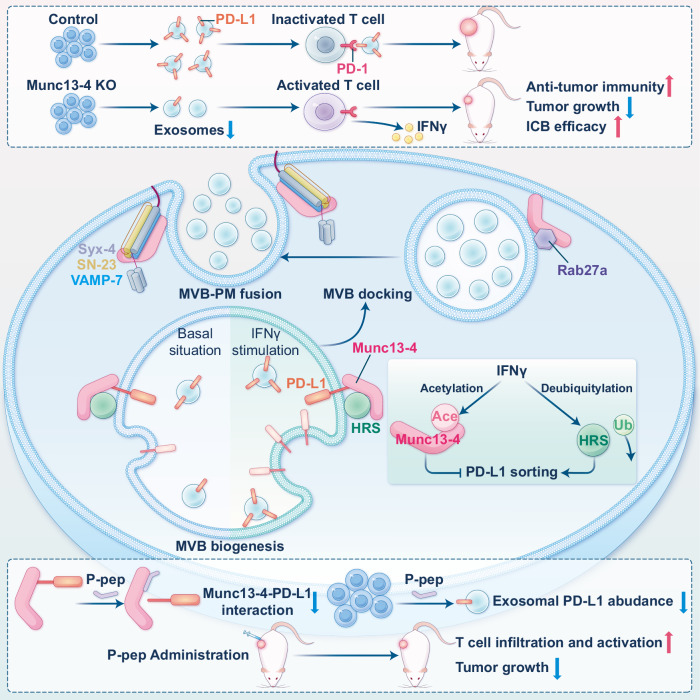
PD-L1–PD-1 軸是腫瘤免疫逃逸的經(jīng)典途徑。近年來研究發(fā)現(xiàn),腫瘤細胞不僅通過膜表 PD-L1 抑制 T 細胞,還能將 PD-L1 裝載入外泌體,經(jīng)血液循環(huán)實現(xiàn)遠程免疫抑制。然而,PD-L1 如何被選擇性分選并經(jīng)外泌體分泌仍不清楚。本研究揭示,膜融合調(diào)控因子 Munc13-4 是腫瘤細胞外泌體 PD-L1 分選與分泌的關(guān)鍵分子,闡明其與 HRS–Rab27–SNARE 協(xié)同完成外泌體釋放的機制,并證明干預(yù) Munc13-4 能增強免疫治療響應(yīng)。
結(jié)論1 Munc13-4 在多種腫瘤中高表達,敲除后顯著抑制腫瘤生長
多癌種組織芯片及 TCGA 數(shù)據(jù)分析顯示,Munc13-4 在乳腺癌、肝癌、胰腺癌等多種腫瘤中普遍高表達。研究者利用 CRISPR-Cas9 敲除 4T1 乳腺癌細胞中的 Munc13-4,結(jié)果在小鼠原位模型中顯著抑制腫瘤生長,腫瘤體積僅為對照的約17%。進一步在免疫缺陷小鼠(Nude、NOD/SCID)中對比發(fā)現(xiàn),缺乏 T 細胞或wan全免疫缺陷后,這種生長抑制效應(yīng)基本消失,提示 Munc13-4 促進腫瘤進展依賴完整免疫系統(tǒng)。該結(jié)果確立了 Munc13-4 在腫瘤免疫逃逸中的關(guān)鍵地位。
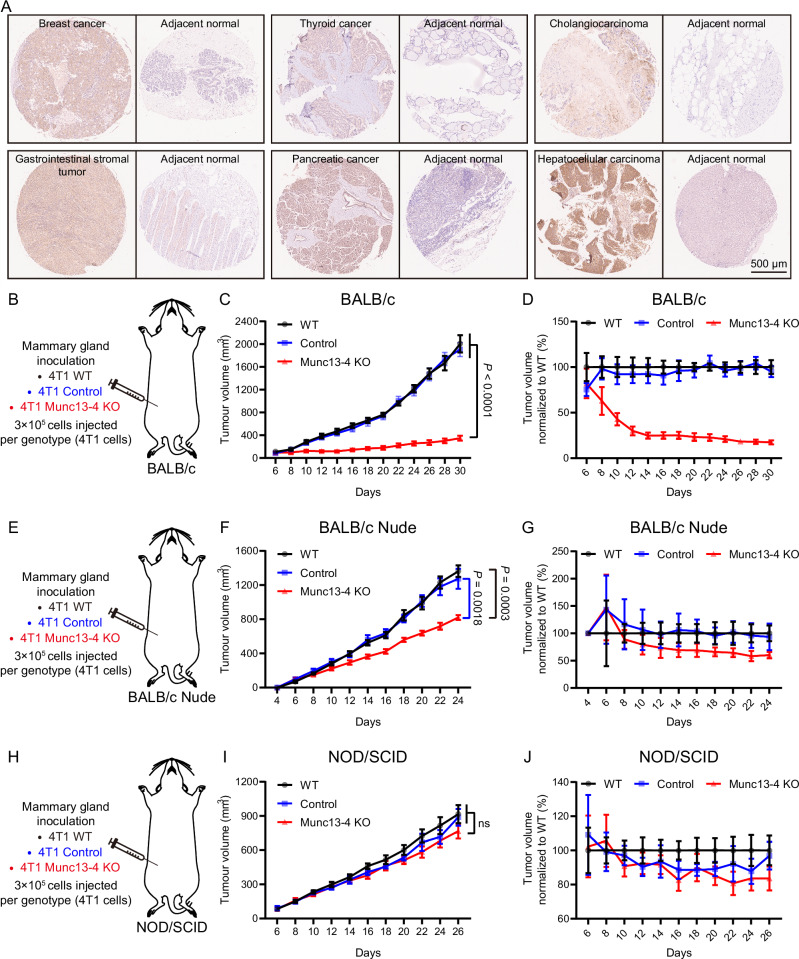
Fig1. Munc13-4 缺失通過免疫依賴性機制抑制乳腺癌生長
結(jié)論2 Munc13-4 缺失增強腫瘤特異性 T 細胞浸潤與活化
為探究 Munc13-4 缺失如何影響免疫反應(yīng),研究者分析了腫瘤、脾臟及淋巴結(jié)中的免疫細胞組成。流式及免疫熒光結(jié)果顯示,Munc13-4 敲除顯著增加腫瘤內(nèi) CD4? 與 CD8? T 細胞浸潤,并提升其活化水平;T 細胞表達的 Granzyme B、Ki67 與 IFNγ 均顯著上升。脾臟和引流淋巴結(jié)中亦觀察到相似趨勢,表明系統(tǒng)性 T 細胞反應(yīng)增強。結(jié)果說明,Munc13-4 的缺失能解除腫瘤對 T 細胞的抑制,強化免疫監(jiān)視和殺傷效應(yīng),從而抑制腫瘤生長。

Fig2. Munc13-4 缺失增強 T 細胞浸潤與細胞毒活性
結(jié)論3 Munc13-4 促進外泌體分泌與其中 PD-L1 的富集
研究進一步探討 Munc13-4 介導(dǎo)免疫抑制的分子基礎(chǔ)。雖然敲除 Munc13-4 不影響細胞總 PD-L1 含量及膜表水平,但外泌體分泌顯著減少,且外泌體中 PD-L1 含量下降約70%。來自 Munc13-4 缺失細胞的外泌體對活化 CD8? T 細胞的殺傷抑制作用明顯減弱,而向小鼠注入對照細胞來源外泌體則可恢復(fù) Munc13-4 缺失腫瘤的免疫逃逸和生長。該結(jié)果表明,Munc13-4 通過促進 PD-L1 隨外泌體分泌至細胞外,削弱 T 細胞殺瘤能力,是腫瘤免疫抑制的核心調(diào)控節(jié)點。

Fig3. Munc13-4 促進 PD-L1 外泌體分泌,削弱 T 細胞殺傷能力
結(jié)論4 Munc13-4 缺失提升免疫檢查點抑制劑療效
鑒于 Munc13-4 缺失可減弱免疫抑制,作者評估其對免疫檢查點抑制療法的影響。在原位乳腺癌模型中,野生型腫瘤對抗 PD-1 或抗 PD-L1 單抗治療反應(yīng)不明顯,而 Munc13-4 缺失腫瘤對兩種治療均顯著敏感,腫瘤體積下降、延緩進展。結(jié)果提示,阻斷 Munc13-4 可顯著增強 ICB 療效,為聯(lián)合免疫治療提供新的分子靶點。
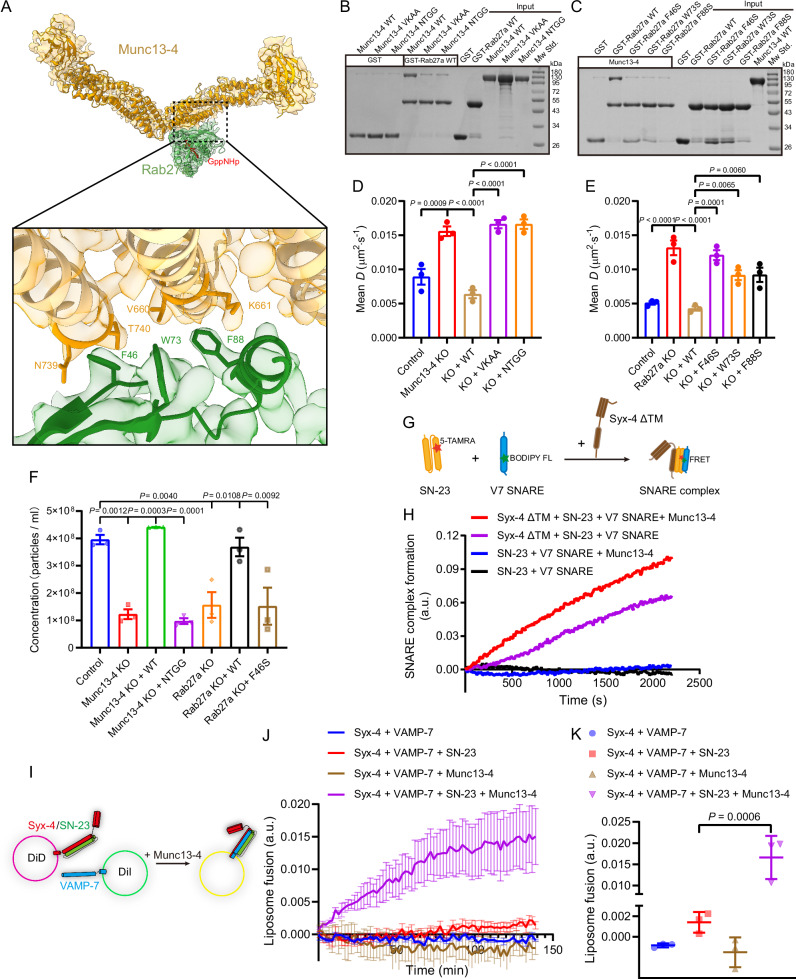
Fig4. Munc13-4 缺失顯著提高抗PD-1/PD-L1療效
結(jié)論5 Munc13-4 與 Rab27a、SNARE 協(xié)同促進 MVB 融合
為闡明 Munc13-4 調(diào)控外泌體釋放的結(jié)構(gòu)機制,作者解析了 Munc13-4–Rab27a 復(fù)合物的冷凍電鏡結(jié)構(gòu)(3.4 ?),揭示關(guān)鍵界面殘基 F46、W73、F88(Rab27a)與 N739、T740、V660、K661(Munc13-4)的相互作用。突變這些殘基顯著削弱結(jié)合,導(dǎo)致多泡體(MVB)靠膜對接受阻、外泌體釋放量下降。進一步實驗顯示,Munc13-4 可促進 SNARE 復(fù)合物(Syntaxin-4/SNAP-23/VAMP7)組裝并增強膜融合。該部分確立了 Munc13-4 在 MVB 融合與外泌體分泌中的分子作用機制。

Fig5. Munc13-4–Rab27a–SNARE 復(fù)合體促進 MVB 融合與外泌體分泌
結(jié)論6 Munc13-4 與 HRS 共同介導(dǎo) PD-L1 外泌體分選
Munc13-4 不僅調(diào)控外泌體釋放,還決定 PD-L1 的裝載。共聚焦顯示,Munc13-4 缺失導(dǎo)致 PD-L1 由與 CD63 共定位轉(zhuǎn)為與溶酶體標(biāo)志 LAMP1 共定位,提示其被錯誤降解。HRS(ESCRT-0組分)敲除同樣減少外泌體 PD-L1。免疫共沉淀及 PLA 分析發(fā)現(xiàn) Munc13-4 同時與 HRS 和 PD-L1 結(jié)合,三者形成穩(wěn)定復(fù)合體;HRS 缺失不影響 Munc13-4–PD-L1 結(jié)合,說明 Munc13-4 與 HRS 協(xié)同而非依賴關(guān)系。結(jié)果揭示 Munc13-4–HRS–PD-L1 三元復(fù)合體是 PD-L1 被準確分選入外泌體的關(guān)鍵機制。
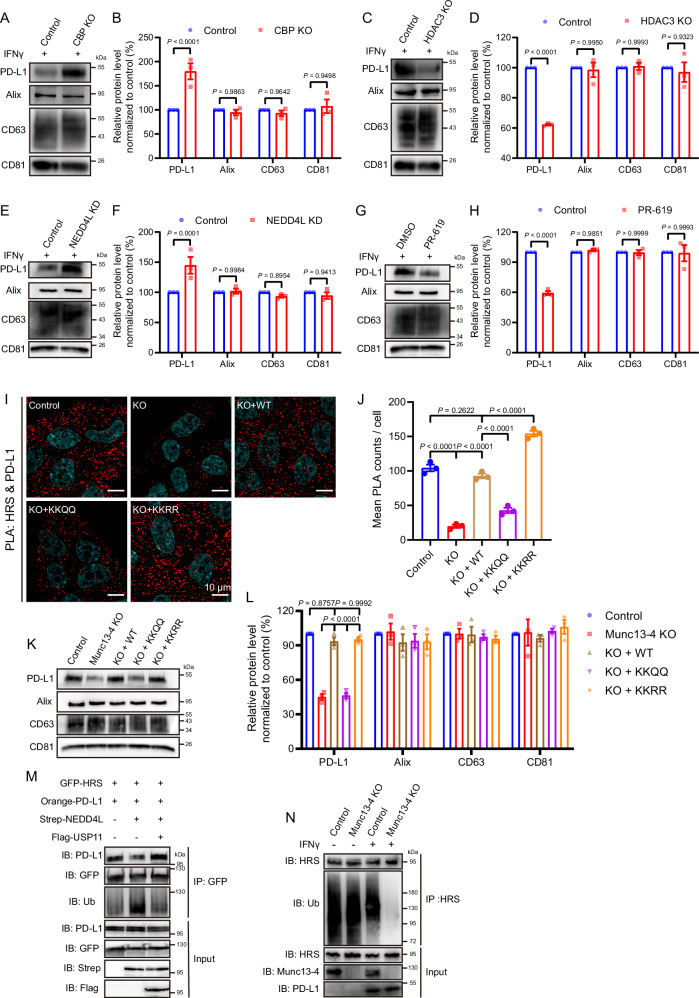
Fig6. HRS–Munc13-4–PD-L1 復(fù)合體決定 PD-L1 外泌體分選
結(jié)論7 IFNγ 信號通過修飾 Munc13-4 與 HRS 動態(tài)調(diào)節(jié) PD-L1 分選
最后,作者發(fā)現(xiàn) IFNγ 信號可通過翻譯后修飾動態(tài)調(diào)節(jié) Munc13-4–HRS 復(fù)合體功能。IFNγ 顯著上調(diào) PD-L1 蛋白并增加外泌體 PD-L1 載量,卻不改變外泌體總數(shù)。機制上,IFNγ 促進 CBP 介導(dǎo)的 Munc13-4 乙酰化,抑制其促進分選的功能;同時觸發(fā) HRS 去泛素化(由 NEDD4L/USP8 調(diào)控),增強其裝載能力。兩種修飾方向相反,gong同平衡 PD-L1 外泌體輸出。該結(jié)果揭示 IFNγ 信號通過精細調(diào)控 Munc13-4 與 HRS 的修飾狀態(tài),動態(tài)塑造腫瘤免疫逃逸能力。
Fig7. IFNγ 通過乙酰化/去泛素化精細調(diào)控外泌體 PD-L1 裝載
總結(jié)與展望
本研究系統(tǒng)揭示了 Munc13-4–HRS–Rab27–SNARE 信號軸在外泌體 PD-L1 分選與分泌中的全程作用機制:Munc13-4 與 Rab27a、SNARE 復(fù)合體協(xié)同驅(qū)動 MVB 融合釋放,同時通過與 HRS、PD-L1 形成復(fù)合體完成 PD-L1 裝載;IFNγ 通過乙酰化與去泛素化修飾進一步調(diào)節(jié)此過程。研究還設(shè)計了能阻斷 Munc13-4–PD-L1 結(jié)合的肽段,顯著增強抗腫瘤免疫與檢查點療法療效。該成果定義了外泌體免疫逃逸的新機制,并提出“靶向 Munc13-4 介導(dǎo)的外泌體通路"作為提升免疫治療反應(yīng)的新方向。
歡迎您關(guān)注我們的微信公眾號了解更多信息
 掃一掃
掃一掃